PROFILE / 系統簡介
ISO 13485 醫療器材品質管理系統簡介

由於時代的進步,人類對於醫療衛生的需求也越來越多,造成了醫療器材製造業的普及。有鑒於醫療器材在發揮醫療之功效時其本身亦存在著風險,因此各先進國家對於醫療器材皆有品質系統與法令法規之要求,以確保醫療器材之有效性與安全性。
然而若世界各國對醫療器材皆有不同之品質系統與法規要求的話,醫療器材業者在遵守這些要求時必然窒礙難行或無所適從。ISO 13485的適時出現,為醫療器材業者在品質系統上,開創出一條大家都能共同接受與遵守的寬廣道路,如同IATF 16949涵蓋了汽車業共同要求與顧客的特殊要求,ISO 13485亦涵蓋了醫療器材業的共同要求與法令的特殊要求,能夠通過ISO 13485,就能開啟企業進入醫療器材市場的康莊大道。
ISO 13485是規範醫療器材品質管理系統,以ISO 9001為藍本,特別強調滿足醫療器材法律法規的要求,對於ISO 9001中不適於作為法規的要求也進行刪除或修改。ISO 13485內容包含對安全的要求、風險分析及評估、訊息回饋機制、上市後的監督、客戶抱怨調查與召回等等。
根據醫療器材行業特性,標準要求形成文件(例如,程序、指導書等)的部分有20多處,顯見ISO 13485對具體操作有更明確的要求。同時,ISO 13485是產品取得CE驗證的必要條件。
13485:2016並無採用ISO 9001:2015之高階管理架構(High Level Structure, HLS) ,因ISO/TC 210認為ISO 9001:2008 標準的內容,比較能夠滿足醫療設備供應商、 監管機構和客戶的需求。
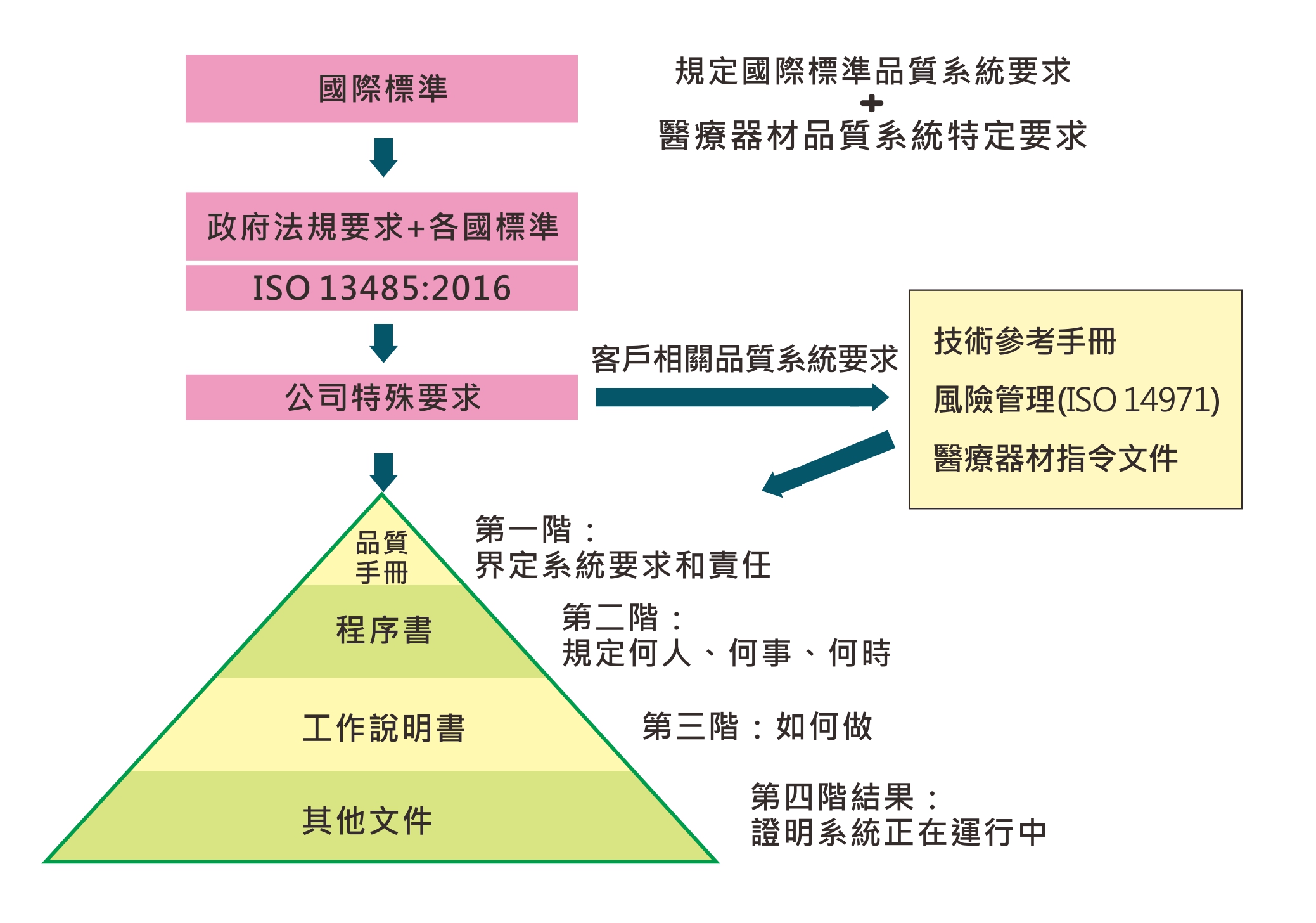
系統架構
ISO 13485:2016是依據ISO 9001:2008的基礎,加上醫療器材之特殊管理要求,並於條文中結合組織所在地的法令法規所建立的品質管理系統。此種品質管理系統由於是依據ISO 9001:2008為基礎,故仍有ISO 9001所具有的PDCA持續改善之精神。在此精神之下,ISO 13485既能輕易與ISO 9001相容,亦能納入法令法規之要求以達到醫療器材之安全性與有效性。另外,ISO 13485 之醫療器材之風險分析係參考另依國際標準:ISO 14971作為風險管理之指導綱要
為何要推行ISO 13485?
ISO 13485是於歐盟技術指令93/42/EEC中明訂銷售醫療器材至歐盟之業者所需導入之品質管理系統,亦是其他地區各國所廣泛接受之醫療器材業之品質管理系統標準。因此推行ISO 13485是醫療器材業者建立顧客信任與符合法令法規最好的橋樑。
適用對象
舉凡是醫療器材之設計、製造或銷售之業者,皆可以導入ISO 13485。至於醫療器材之定義,在ISO 13485本身之辭彙解釋中已有說明,茲摘錄如下:
醫療器材(medical device)
醫療器材是指組織所提供之儀器、裝置、設備、材料或其他物品,可單獨使用或組合一起使用,並包括使用上需搭配之軟體。
意圖使用在人體作為:
‧診斷、預防、監控、治療或減輕疾病
‧診斷、監控、治療、減輕或修補傷處或殘障部位
‧解剖或生理過程中之檢查、換置或修正
‧避孕
這些醫療器材不可能藉由藥性、免疫性或新陳代謝在人體達到其主要設計目的,但前述方法能扮演輔助作用。
依據上述之定義可以得知,不管是醫療器材成品,或是醫療器材之零件、附件或配件之廠商亦可以導入ISO 13485。
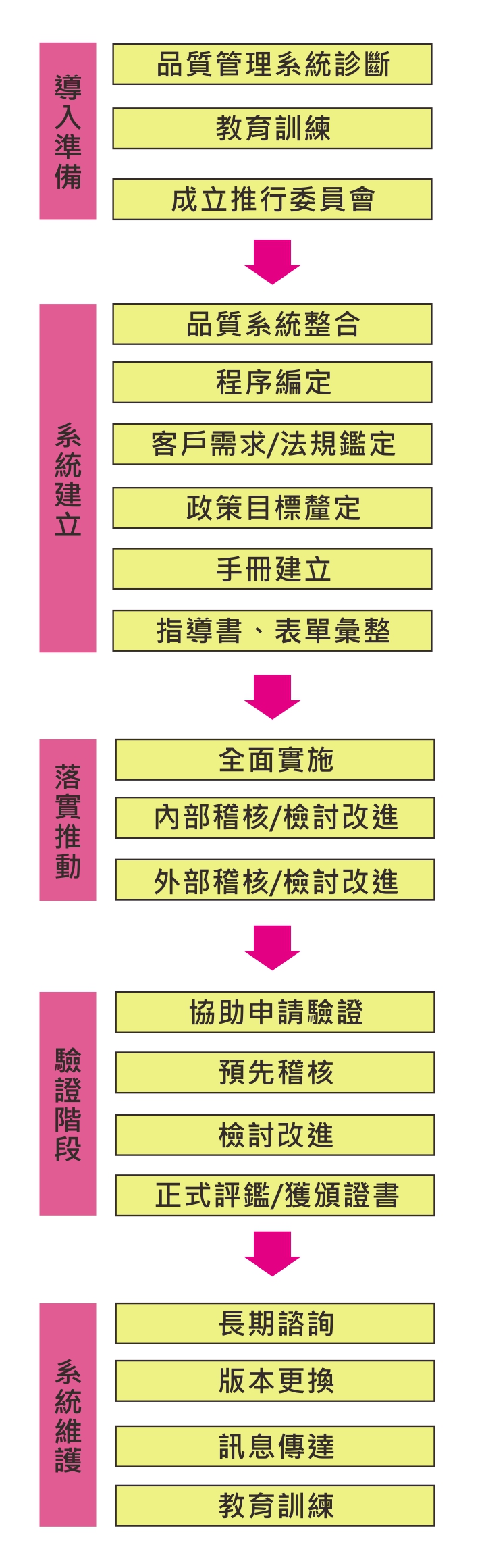
輔導流程
REPORT / 新聞稿
-
2020.10.22
科建顧問-醫療口罩廠ISO 13485專業輔導、快速取證。

科建顧問-醫療口罩廠ISO 13485專業輔導、快速取證。
疫情尚未解除,口罩已成民眾每日必備品,據報載預估全球口罩商機上看至少3兆6500億元,此龐大的商機,也吸引了各路業者投入口罩生產行列,冀望能搶得商機,其中不乏原來不是生產醫療器材之廠商。據科建顧問近期之接觸,有半導體業、電子組裝業、印刷業、塑膠業、紡織業…等,各採用現有廠房或新建廠房方式投入市場戰局。
但,醫療用口罩屬於醫療器材,必須遵守相關法規,取得證照才能合法製造或販售。近期就有幾件關於口罩廠商違法的新聞;另外,大家一窩蜂投入口罩市場,會不會造成供過於求,類似蛋塔效應的泡沫化情形發生呢?
因此,業者如何做好品質保證作業、提昇企業形象,賺得快、賺得久、賺得穩,應是目前生產口罩及將投入口罩生產之業者,必要思考的重要策略議題。
依照我國政府對醫療器材的管理規定,業者除了應具備合法之公司登記,工廠登記證,製造業藥商許可執照、販賣業藥商許可執照外,尚需建立醫療器材品質管理制度,使符合醫療器材優良製造規範(GMP)之要求,產品品質需符合規定的檢驗標準後,取得醫療器材許可證,上市後更要有有效的制度持續監督產品之療效及安全性。除了國內市場外,拓展外銷市場更需具備ISO 13485證書及符合當地國家相關法令法規規定,因此要加入口罩隊搶商機,除了搶上市進度外,建立及維持有效運作的品質管理系統,才是永續經營之道。
科建顧問自1987年成立以來,專注於輔導協助國內、外廠商,建立各項ISO管理系統(輔導實績超過1萬3千家)。其中,在醫療器材品質管理系統(GMP、ISO 13485、FDA)輔導領域,不論在醫療器材類別的廣度及輔導之家數,均為顧問業領導者。經驗豐富的顧問師群,能以合理價格,快速、有效提供相關諮詢及輔導服務,讓您在這波商機中能領先競爭對手,賺得快、賺得穩,賺得更久。
-
2016.11.25
新漢股份有限公司-ISO 13485醫療器材系統之導入推動
新漢股份有限公司(上櫃代號:8234)自1992年11月創立至今,致力成為客戶值得信賴的智能解決方案建構夥伴;新漢憑藉其優秀研發團隊在IPC產業數十載的經驗,設立品保中心、提供技術支援服務,並在24小時內提供客戶解決方案,建立全面品質保證,及藉助其核心能力,幫助客戶在不同垂直巿場領域,贏得無數重要的專案,創造出巿場差異化。、超越客戶期許為超越客戶期許,新漢憑藉其在IPC產業數十載的經驗、優秀的研發團隊、和優質的客戶服務且設立品保中心,以確保全面品質保證,亦提供技術支援使新漢能在24小時內提供客戶解決方案,創造巿場差異化。藉由其核心能力,新漢幫助客戶,在不同垂直巿場領域,贏得無數重要的專案。
新漢的企業文化秉持的是顧客至上、品質第一、即知即行,更重要的是,持續創新,、突破現有的框架,根據市場的導向,引領技術創新。因此,2016的夏天,新漢決定投入醫療器材產業並與科建管理顧問合作,建置ISO 13485醫療器材品質管理系統。希藉由新漢在產業電腦及嵌入式電腦應用產品超過數十餘載的專注研發經驗和及科建顧問提供的專業輔導與和教育訓練下,建立健全的制度、;符合系統法規要求及風險分析管理,以長遠達到客戶對新漢的肯定。
科建顧問為大中華區輔導ISO國際標準管理系統之第一品牌,同時通過ISO 9001與ISO 27001驗證之顧問公司,提供完整專業診斷輔導服務,擁有超過10,835913家次(截至2016年0910月)之企業輔導實績,協助企業快速建立管理系統並取得國際證書,欲了解相關資訊內容,請上科建網站查詢http://www.kind.com.tw,
-
2016.06.27
台灣維順工業(股)公司委由科建顧問輔導ISO 13485改版與導入ISO 14001
台灣維順工業(股)公司,創立於1995年,專營生產電動代步車、輪椅,以及便器椅、洗澡椅、醫療等相關產品,近期委由科建顧問輔導導入「ISO 14001:2015環境管理系統」與進行「ISO 13485:2016醫療器材品質管理系統」改版作業。
台灣維順工業已於2007年順利導入ISO 13485醫療器材品質管理系統,使產品符合法規之要求,而醫療器材的生產過程中,仍可因製程、材料影響產品之安全性與穩定性,甚至破壞社會環境;ISO 13485於今(2016)年2月發佈新版,台灣維順工業則委由科建顧問進行「ISO 13485:2016醫療器材品質管理系統」改版作業與輔導「ISO 14001:2015環境管理系統」之導入,期望各產品線之產品能符合相關法令法規之要求,降低風險與降低對環境的污染,並追求企業能穩健發展且永續經營。
-
2014.07.30
詮欣股份有限公司 通過ISO13485醫療器材系統驗證
詮欣集團創立於1985年,秉持著『誠信務實、創新求進、品質至上、永續經營』的經營理念,專業設計並生產連接器及連接線。
本公司於2001起,陸績獲得小巨人獎與國家磐石獎,
開發完整系列產品應用在消費/工業/網路電信/醫療/汽車/軍用..等領域
Cable (USB3.0/HDMI/DP)
Smart Cable (USB/DP/HDMI/MHL/SATA)
OTG (Cable/Adapter/Reader/Long Stay)
Memory Conn.(USB/SIP/SD/CF)
QSFP Conn.( 1X6/1X1)
Waterproof (Conn./Cable)
且擁有各項世界專利與認證,逐漸成為世界級的連接器專業製造廠。在詮欣吳連溪總經理指示及全力支持下,2013年底選定在國內輔導經驗豐富之科建顧問為輔導顧問團隊,在科建顧問蔡秉文老師及詮欣ISO13485推行委員會成員的共同努力下,歷經法律法規符合度查檢、風險分析因應、制度建立、實施及稽核改善等過程,建立了具備P-D-C-A管理循環及持續改進的完整管理系統,2014年6月通過法國標準協會(AFNOR)集團驗證並獲頒證書。
使詮欣集團完善的品質系統 (ISO9001,ISO14001,ISO16949,ISO13485)成為競爭優勢。
詮欣吳連溪總經理在公司經營會議中期許各級主管,在醫療產品的發展上要了解客戶的用途做好風險分析,在建全的制度下,要透過教育訓練及溝通,使全體同仁能了解並遵照公司規定落實實施,各階主管必須定期稽核並提出持續改善計畫,進而獲得客戶肯定及創造口碑。
ARTICLES / 文章分享
-
2016.03.01
ISO 13485:2016 改版重點說明
ISO 13485:2016 於2015年12月完成FDIS 版,將於2016年3月正式發佈。舊版ISO13485將有3年的轉換期。
本次ISO 13485:2016年版轉版,更適用於整個醫療器械產業相關的組件和服務的供應商,所以包含的供應鏈更廣。
而這次改版,原本期待新的ISO 13485標準會使用最新ISO 9001:2015年版的高階架構標準,但ISO TC 210委員會覺得ISO 9001:2008年版標準更符合醫療設備供應商,監管機構和客戶的需求,所以決定不跟進高階架構的管理系統標準行列。
而ISO 13485:2016年版標準排除條款的彈性增加,在過去,組織僅可以排除第7章產品實現的要求。現在,可以排除第6章、第7章或第8章的任何條款,只要充分說明理由,且證實組織流程或產品性質的確如此,即可排除。
改版也具體針對以下條文進行補充解釋:
1.管理職責
2.矯正及預防措施(CAPA)
3.軟體確效
4.供應鏈
5.外包
6.風險管理
7.上市後活動
8.過程確效
9.產品生命週期管理
而ISO 13485:2016年版特別注意事項:
1.明確希望組織可以遵守所有適用的法規要求
2.基於風險的方法,應將所有過程納入風險考量(包括外包過程)
3.記錄包括各醫療設備或器件系列,包括所有相關的規範、程序和記錄。
4.你的產品和產品用戶的相關的培訓需求,並驗證法規要求將被滿足,必要時,應在客戶使用產品前,完成用戶培訓。
5.應確保供應商都能夠滿足組織的法規、法令及評鑑需求。
6.必要時,應建立驗證計劃和重新驗證過程。
7.分析維修記錄來識別服務的投訴和改進的機會。
8.調查不合格已交付的產品,確認是否進行矯正行動,並考慮利害關係人是否應得到通知。
9.實施糾正和預防措施, 確認是否遵守執行及適用法規要求,且不損害安全及醫療設備的性能。
-
2010.09.08
電子業導入ISO 13485之實務討論
隨著時代之進步,人類對於醫療衛生與健康保健之要求亦越來越提高,因此,自金融海嘯以後,很多製造業者紛紛尋求醫療器材產品之發展;目前國內醫療器材業發展,逐漸以電子業與生技產業為兩大主流,且其用途由醫院醫生或專業人員使用,逐漸轉向病患個人於院外居家照顧使用。有鑒於此,電子業者近年遂大量轉向血糖計、血壓計、血氧濃度儀、耳溫槍、心電圖瞄記器等產品之研發製造,但這些電子業者多半其本業並非醫療器材產品,故於導入ISO 13485時多有陌生不解、應用無所適從之情形,為使電子業者能熟悉導入作法,特於此撰文作淺論說明。
電子業者做醫療器材第一個問題是:安規檢驗應納入何項條款要求?基本上電子業者的醫療器材產品被ISO 13485歸為主動式醫療器材( active medical device),應依據IEC 60601-1等安規作電磁相容性等測試,此種測試多半於設計過程中即應予以測試合格,所以安規檢驗應納入7.3.5設計與開發之查證的條文要求作設計查證。
電子業者做醫療器材第二個問題是:風險管理作業應於何作業過程中實施?ISO 13485條文7.1有提到組織應實施風險管理活動,並參考ISO14971作為指引文件,但條文7.3.2設計輸入中又有提到(e)風險管理輸出,故風險管理作業應最好於設計開發之作業流程中實施,並將分析出來判定為不可接受的風險轉為設計入的資料,於後續設計過程中將該風險予以降低或消除,此乃最理想的處理方式。
電子業者做醫療器材第三個問題是:電子醫療器材產品使用壽命應如何制訂?有部份電子業者會對醫療器材產品做可靠度試驗壽命試驗,以求其平均失效間隔MTBF作為制訂產品使用壽命的依據,此乃最標準的方法。若未測試MTBF者,則可鑑別產品中關鍵零件( key component )的使用壽命,作為制訂產品使用壽命參考,例如:電動代步車的關鍵零件為馬達,若馬達的使用壽命為五年,則可能意味著電動代步車的使用壽命亦為五年。
電子業者做醫療器材第四個問題是:電子醫療器材是否需要符合RoHS之有害物質規定?基本上RoHS的指令是排除醫療器材產品的適用,所以電子醫療器材可以不需要符合RoHS有害物質規定,當然,若業者自願使用無有害物質零件生產是更好的,但其前提是不能因為使用無有害物質(HSF)零件導致醫療器材功能降低或產生較高的風險。
以上是我們對於電子業者做醫療器材時的實務問題所作的探討,其目的是希望能提供業者符合標準條文要求之作業方法,以俾能降低業者導入ISO 13485的障礙,順利獲得驗證通過以開展國內外市場。
-
2007.02.05
ISO 13485品質管理系統與歐盟醫療器材管理導入要點
自從 ISO 9001國際標準問世以來,各行各業無不積極導入並推行此品質管理系統。然而 ISO 9001在建立品質管理系統上,僅能作為基礎要求,對於某些特殊行業別而言,這樣基礎的要求是不足的。 因此在ISO 9001之後,又陸續出現汽車供應鏈所引用的 TS 16949,以及通訊產業所引用的 TL 9000 等特定行業的品質管理系統。有鑑於此,歐盟地區亦為醫療器材業制訂其適用之系統標準:即EN 46001 與 EN 46002 ,作為管理醫療器材業之系統要求。隨後在歐盟與國際標準組織 ( ISO ) 的技術委員會 TC 210 的合作之下 , 將 EN 46001 轉換為國際標準ISO 13485,EN 46002轉換為國際標準ISO 13488,於是醫療器材業所引用之國際標準於1996年正式發行生效。因應 ISO 9001 於2000年改版,ISO 13485亦在2003年首次改版, 將ISO 13485與ISO 13488合併為ISO 13485。
ISO 13485制訂發行以後,便被歐盟作為管理醫療器材業的系統依據。現代國際社會對於產品安全之管理, 主要的方式不外乎組織的品質管理系統要求與產品的安規認證。因此歐盟地區在管理醫療器材業時,便將醫療器材之CE認證與ISO 13485結合,作為管理醫療器材業之模式。歐盟在管理醫療器材時,首先針對醫療器材之風險高低分為4級:I 級稱為低風險醫療器材,IIa 級稱為中低風險醫療器材,IIb級稱為中風險醫療器材,III 級稱為高風險醫療器材。此種分級的方式係依據歐盟自己所制訂之技術指令與指引文件 。茲將歐盟對各級醫療器材之管理模式整理如下表:
註1:若有滅菌要求與量測功能之醫療器材仍需要導入ISO 13485。
註2:自我宣告符合CE者其CE MARK沒有號碼。
註3:xxxx表示認證單位(Notified Body,NB)號碼,例如:SGS之號碼為0120,DNV之號碼為0434。
經由表一之內容我們可以發現,I級醫療器材若有滅菌要求或者是量測功能者,都需要導入 ISO 13485 ,且導入時沒有排除條款之限制,IIa 級亦同。但如果是IIb 級以上之醫療器材,其導入之 ISO 13485 不可以排除設計開發,此點與我國衛生署之管理方式略有不同 ( 依據我國衛生署之規定,醫療器材業者於推行醫療器材優良製造規範(GMP)時均需納入設計開發)。所以在推行 ISO 13485 之前組織應先鑑別本身品是否為醫療器材,確定為醫療器材後,再鑑別該醫療器材之等級,確定等級以後再鑑別其排除條款, 因此導入ISO 13485 之過程與 ISO 9001不甚相同。另外,ISO 13485主要的精神在於產品之安全性與有效性 (參見表二 ),與ISO 9001之主要意涵相異,故通過ISO 13485之組織不可宣稱其符合ISO 9001。由於歐盟與美加地區佔全世界七成以上之醫療器材市場,故導入 ISO 13485品質管理系統對於醫療器材業者打入歐美市場有極顯著之效益,即使非歐美地區國家,亦常常比照歐盟之規定作相同之要求,即使是在國內銷售之醫療業者,也可以以ISO 13485 作為推行醫療器材優良製造規範(GMP)之基礎。隨著世界各地社會老年化趨勢,各國老年人口越來越多,醫療保健的產業求應會逐年成長,因此,在未來的醫療器材市場,可以預期ISO 13485將會越來越被接受與推廣。



